小鼠杂交瘤单克隆抗体制备技术研究进展
小鼠杂交瘤单克隆抗体来源稳定、后期易制备、产量高,是免疫学中使用最为普遍的抗体。本文从B细胞富集与筛选、融合技术的改进、阳性杂交瘤细胞筛选方面进行阐述,以期为系统化的小鼠杂交瘤单克隆抗体的快速制备方法提供参考。
1. 小鼠杂交瘤融合技术
1.1 常规小鼠杂交瘤融合技术
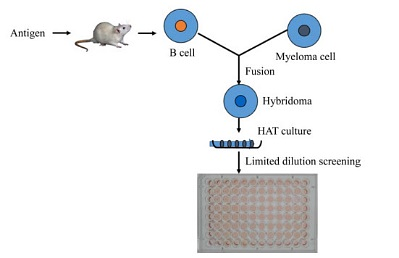
小鼠杂交瘤是在抗原经鉴定后进行制备,免疫动物,测定血清效价,效价合格后,将脾细胞和骨髓瘤细胞融合,经过HAT选择性培养基筛选和间接酶联免疫吸附测定(Enzyme linked immunosorbent assay,ELISA)筛选确认,获得的杂交瘤既能无限增殖又能分泌针对抗原特异性的杂交瘤抗体[1],具体流程如图 1所示。
1.2 转基因小鼠杂交瘤技术
通过转基因技术将编码人源的抗体基因转入到抗体基因缺失的小鼠中,根据转入的基因不同,可将转基因小鼠杂交瘤制备的抗体分为嵌合抗体和全人源化抗体。嵌合抗体是将鼠源抗体的可变区基因与人源抗体的恒定区基因通过DNA重组拼接,与载体进行组装,转染至细胞中表达的抗体分子。因其减少了鼠源成分,从而降低了鼠源抗体引起的排斥反应,并有助于提高疗效。
2. B细胞富集与筛选
小鼠的淋巴器官由多种类型的细胞组成,包括非B细胞系(40%–60%)和表达IgM “幼稚” B细胞(40%–60%)和其他淋巴细胞(< 5%),任何一种细胞均可用于融合,但是只有表达IgG的B细胞(主要为浆细胞)与骨髓瘤融合后才有可能形成分泌单克隆抗体的杂交瘤细胞,且只有小部分细胞(0.2%–5%)表达抗原特异性抗体。传统的杂交瘤技术以聚乙二醇(Polyethylene glycol,PEG)作为融合剂,将脾细胞与骨髓瘤细胞融合筛选杂交瘤,该方法融合效率低,只有5×10–6,因此,有必要对效应B细胞进行筛选和富集,提高融合率。
目前,对B细胞的分选主要依赖流式细胞仪或采用联合抗小鼠IgM的抗体和小鼠Pan-B细胞分选试剂盒(Miltenyi)去除IgM+细胞和非B细胞,实现对效应B细胞的富集。
目前,对B细胞的分选主要依赖流式细胞仪或采用联合抗小鼠IgM的抗体和小鼠Pan-B细胞分选试剂盒(Miltenyi)去除IgM+细胞和非B细胞,实现对效应B细胞的富集。
3. 融合技术的改进
3.1 常规融合技术
常规的杂交瘤融合技术,主要是将一定数量比例的小鼠脾细胞和骨髓瘤细胞在PEG作用下,小鼠脾细胞和骨髓瘤细胞融合为杂交瘤细胞。
3.2 电融合技术
电融合技术是指将脾细胞与小鼠骨髓瘤细胞在电脉冲场的作用下融合为杂交瘤细胞的技术,该方法避免了常规融合技术的化学试剂污染。但电融合法生产杂交瘤的效率仍然较低,其原因在于两种细胞在融合前的排序是随机结合,尤其是当两种细胞大小有较大差异时,排序电压更容易让大细胞与大细胞接触,而需要融合的两种细胞接触机会减少,导致融合效率降低。
4. 阳性杂交瘤分选
4.1 常规阳性杂交瘤分选方法
常规筛选阳性杂交瘤分选方法是在杂交瘤融合后,经过选择性培养基和间接ELISA筛选,轻轻将阳性杂交瘤细胞吹起并计数,采用有限稀释法将杂交瘤细胞铺到96孔板中,并于第二天在倒置显微镜下查孔,查含有单个细胞的微孔或几个细胞紧挨着的小细胞团。有限稀释法的次数取决于单个杂交瘤细胞的获得,且每次亚克隆培养时间需要7–10 d,并需要间接ELISA进行阳性确认。有限稀释法决定了亚克隆不能一次就获得单个杂交瘤细胞,需要反复再反复,直至克隆到单个细胞为止。细胞培养操作烦琐,工作量大,且会在多次克隆中丢失一些其他亚型的杂交瘤细胞。
4.2 半固体筛选方法
为了克服有限稀释法的缺陷,1982年Davis等利用甲基纤维素构建了半固体培养基,使杂交瘤能够在半固体培养基中有效地形成单细胞群落。甲基纤维素半固体培养基克隆化培养杂交瘤细胞比有限稀释法要容易许多,主要是融合细胞彼此分离,呈集落生长,相互不干扰、不混杂,一步即可完成单克隆的分离工作。采用半固体筛选后的杂交瘤细胞,还需进一步扩大培养,通过间接ELISA方法确认单个杂交瘤细胞对抗原的特异性。由于未能对单细胞群落细胞所产生的抗体进行有效测定,需要将半固体培养基中所有的细胞挑选出来,挑选的工作难度依然很大。
4.3 细胞膜荧光免疫吸附测定法
在甲基纤维素半固体细胞培养基中,杂交瘤细胞能够有效地形成单细胞群落,在基于半固体快速筛选方法中,如何快速筛选产抗原特异性抗体杂交瘤细胞成为关键。Akiko和Yoshimoto等分别利用“油链”连接捕获抗体,“油链”锚定在细胞上,细胞分泌的抗体被“油链”的捕获抗体所捕获,加入的荧光标记的检测抗体与分泌的抗体结合,实现了对产抗体的杂交瘤细胞的识别。
%20%E5%8F%8A%E6%93%8D%E4%BD%9C%E8%BF%87%E7%A8%8B%E7%A4%BA%E6%84%8F%E5%9B%BE(B).png)
4.4 微流控芯片筛选方法
微流控从运行方式分为管道微流控和液滴微流控,应用于细胞分选的微流控较多,而用在阳性杂交瘤筛选的主要是液滴微流控。液滴微流控中单细胞在液滴中的分隔使细胞上的或分泌的蛋白分析成为可能,从而克服了传统的流式细胞仪和荧光激活分选细胞的一些主要限制。

4.5 仪器全自动筛选方法
4.5.1 流式细胞仪筛选方法
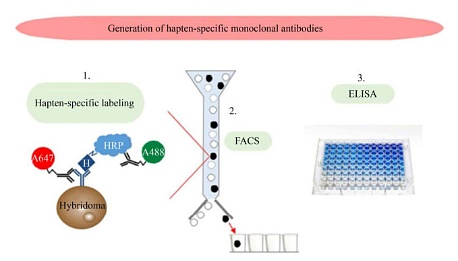
流式细胞仪(Flow cytometer)基于对荧光标记抗原与抗体亚型结合免疫球蛋白作为筛选指标,能够全自动、快速、高效地对针对抗原特异性且活的杂交瘤细胞进行筛选。Dippong等利用过氧化物酶标记的半抗原与荧光标记的抗过氧化物酶的抗体偶联物检测抗体的特异性,用荧光标记的抗小鼠IgG的抗体鉴定抗体的分泌(图 4-1),利用荧光激活细胞分选技术(FACS)将融合混合物中半抗原特异性的单个杂交瘤细胞分选于多孔板中进行培养(图 4-2),通过直接竞争ELISA检测方法确认(图 4-3),最后得到了分泌特异性单克隆抗体杂交瘤的方法,避免了烦琐的重复筛选和克隆过程,为其他半抗原特异性抗体制备提供参考。
4.5.2 ClonePix FL筛选方法
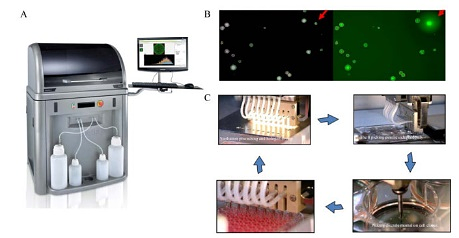
ClonePix FL是Thermo一款全自动杂交瘤细胞筛选平台,其外表如图 5A所示。其原理是杂瘤细胞在半固体培养基上形成分散的克隆群落,杂交瘤分泌的抗体与培养基中的荧光标记检测试剂或者接种后加入的荧光检测试剂结合,在杂交瘤细胞周围形成荧光聚集的现象,ClonePix FL图像识别软件对荧光进行识别、定位(图 5B),并根据信号指令,自动地将阳性细胞挑选至96孔板中扩大培养(图 5C)。加入的荧光标记物不同,检测的细胞不同,ClonePix FL可以进行多重细胞的挑选。目前,ClonePix FL广泛用于重组蛋白抗体药物细胞的筛选,Bowen和Nakamura等采用ClonePix FL优化和筛选单克隆抗体高产CHO细胞系。
5. 总结
小鼠杂交瘤单克隆抗体快速制备技术涉及很多环节,包括B细胞富集筛选、融合技术改进及阳性杂交瘤细胞筛选,对每个环节进行优化并进行系统化组合改建,仍然值得进一步探究。
原文出处:方水琴,刘程,马俊飞等.小鼠杂交瘤单克隆抗体快速制备技术研究进展[J].生物工程学报,2021,37(07):2293-2306.DOI:10.13345/j.cjb.200275.
